Ферментные препараты в борьбе с тобамовирусом
Вирусы овощных культур в России начали активно изучать с 90-х годов прошлого столетия. Результаты фитомониторинга показали, что производственные посевы овощных культур в тепличных хозяйствах на 50-100% поражены главным образом двумя вирусами – огуречной (Cucumber mosaic virus, CMV) и табачной мозаики (Cucumber green mosaic virus, CGMV).
Эти вирусы оказались самыми распространенными на тыквенных овощных культурах. При этом с каждым последующим годом количество поражаемых растений увеличивалось.
Вирус огуречной мозаики (ВОМ)
Род Cucumovirus, семейство Bromoviridae. Полифаг, встречается на всех континентах и является одним из самых широко распространенных и вредоносных вирусов для большинства овощных культур. Вирионы вируса сферические, диаметром 25–30 нм.
Вирус зеленой крапчатой мозаики огурца (ВЗКМО)
РНК-содержащий вирус, который поражает растения семейства тыквенных, вызывая потерю урожая до 40%.
Гены устойчивости к ВЗКМО не описаны, часто для защиты от патогенных штаммов применяют аттенуированные штаммы вируса, которые, не вызывая симптомов заболевания, обеспечивают защиту от патогенных штаммов.

Изучение вирусных инфекций остается актуальным как в России, так и за рубежом. Комплексные исследования с использованием новых современных высокочувствительных методов диагностики вирусов позволяют выявлять ранее не идентифицированные в регионе штаммы.
Симптомы вирусного поражения овощных культур часто трудно отличить от поражений, возникающих у растений под воздействием различных неинфекционных стрессовых факторов (засуха, холод, длительное переувлажнение, недостаток питательных веществ и др.).
Диагностика фитопатогенных вирусов
Точная диагностика в настоящее время стала возможна при дополнении классических приемов идентификации современными биотехнологическими методами, в частности, полимеразная цепная реакция (ПЦР). В связи с интенсивным внедрением гибридов иностранной селекции в производство огурца защищенного грунта возрастает распространение вирусных инфекций, источником которых являются семена.
Известно два вида передачи вирусов через семена: «ложная» передача (seed-borne viruses), при которой вирусы находятся на поверхности семян или в перикарпе, эндосперме; истинная передача (seed transmitted viruses), при которой вирусы проникают в зародыш и при прорастании семян заражают проростки.
Первый вид характерен для вируса зеленой крапчатой мозаики огурца (ВЗКМО) – Cucumber green mottle mosaic virus (CGMMV) из рода Tobamovirus, который весьма распространен в тепличных хозяйствах России. Анализ растительных образцов молекулярно-генетическими методами диагностики показал, что основным возбудителем болезней является ВЗКМО. Однако распространенность его в культурооборотах огурца варьировала в зависимости от возделываемых гибридов. Установлено, что первоисточником ВЗКМО являются семена. Растения огурца, выращенные из инфицированных семян, имели характерные для ВЗКМО симптомы хлороза жилок, мозаичности и морщинистости листьев.
Профилактика ВЗКМО
Согласно данным литературы, наиболее эффективным профилактическим мероприятием против ВЗКМО является термическая обработка семян с последующим замачиванием их в 15 %-ном растворе тринатрий фосфата. Однако даже при обработке семян перед посевом существует вероятность развития вирусных инфекций. Особенно часто возникают неконтролируемые вспышки инфекции в тепличных хозяйствах, применяемых интенсификацию производства, в частности интерплантинг (технологический прием замены растений новыми без перерыва в плодоношении).

Учитывая вышесказанное, в настоящее время является актуальной проблема борьбы с вирусными инфекциями овощных культур защищенного грунта.
Существует большое количество средств для профилактики и борьбы с вирусами, механизм действия которых можно условно разделить на два вида: антибактериальные, воздействующие непосредственно на возбудителя инфекции, но при этом оказывающие угнетающее действие на растение, и препараты, стимулирующие иммунную систему растения, при этом снижая срок плодоношения.
Ввиду сложившейся ситуации важной задачей является разработка и апробация препарата, обладающего прямым действием на вирус, являющегося биоразлагаемым, не токсичным, совместимым с препаратами, применяемыми в технологическом цикле.
Противовирусный препарат Фитовирин
Коллективом новосибирских ученых был разработан противовирусный препарат, обладающий всеми перечисленными выше свойствами. Препарат был разработан на основе фермента продуцента штамма Serratia marcescens, который в комплексе с другими продуцентами, обладает высокой противовирусной активностью относительно ДНК и РНК содержащих вирусов.
Противовирусный эффект препарата достигается за счет неспецифических гидролитических свойств продуцентов, которые гидролизуют как оболочку вируса, так и ДНК/РНК. Ранее нами был проведен комплекс сравнительных исследований по противовирусной активности препаратов Фитовирин и Viron, в которых препарат зарекомендовал себя лучше, чем аналог по всем исследуемым показателям.
Однако до настоящего времени остаются невыясненными механизмы, влияющие на проявление или латентное течение вирусной инфекции, вирусная нагрузка при которой появляются первые визуальные признаки инфекции, взаимосвязь между количеством копий, временем воздействия вируса на растение и визуальными проявлениями инфекции.
В связи с вышесказанным целью нашего исследования являлось изучение действия вируса на растения при искусственном инфицировании и противовирусная активность препарата Фитовирин. Для достижения цели были поставлены следующие задачи:
- Оптимизировать условия применения противовирусного препарата в производственных условиях на овощных культурах защищенного грунта с гидропонным способом выращивания, с автоматизированной системой капельного полива, системой искусственного досвечивания и технологией интерплантинга, без применения интерплантинга и при органическом земледелии.
- Определить противовирусную активность препарата в условиях in vitro и in vivo.
Проверка эффективности препаратов против ВЗКМО
В качестве производственных площадок для проведения исследований были выбраны несколько тепличных хозяйств: тепличный комплекс с применением технологий капельного полива, гидропонного метода и интерплантинга; тепличные хозяйства с применением технологий капельного полива, гидропонного метода без применения интерплантинга; тепличные хозяйства, применяющие технологии органического земледелия (без применения интерплантинга).
Лабораторные исследования проводили в лаборатории энзимного анализа и ДНК-технологий Новосибирского ГАУ. Опыты закладывали на огурцах на участке площадью 1 га.
Обработку начинали с момента появления признаков инфекции еженедельно.
Данный участок был разделен на делянки:
- контрольная, противовирусную обработку на которой производили по технологии применяемой в ТК (Viron), остальные 6 делянок обрабатывали заявленным препаратом:
- 1-я делянка – концентрация препарата 1000 ед.акт. на 1 растение (за единицу активности фермента принимали полное расщепление ферментом 1 мкг ДНК фага λ за 1 час.), трехкратно, с интервалом 1 неделю;
- 2-я делянка – концентрация препарата 1000 ед.акт. на 1 растение, четырехкратно, с интервалом 1 неделю;
- 3-я делянка – концентрация препарата 1000 ед.акт. на 1 растение, пятикратно, с интервалом 1 неделю;
- 4-я делянка – концентрация препарата 1500 ед.акт. на 1 растение, трехкратно, с интервалом 1 неделю;
- 5-я делянка – концентрация препарата 1500 ед.акт. на 1 растение, четырехкратно, с интервалом 1 неделю;
- 6-я делянка – концентрация препарата 1500 ед.акт. на 1 растение, пятикратно, с интервалом 1 неделю.
Проведение лабораторных исследований выполняли на рассаде огурцов, растения были закуплены в количестве 100 шт. Данные растения были разделены на 5 групп по концентрации вируса, который вносился при искусственном инфицировании. Для проведения исследований по определению вирусной нагрузки, соотношения здоровых клеток растения, к количеству инфицированных провирусных клеток были разработаны количественные мультиплексные системы с применением флуорисцентно меченных зондов, для выявления вирусов семейства Tobamovirus (вирус зеленой крапчатой мозаики, вирус обычной мозаики, вирус мозаики томата), являющиеся возбудителями инфекционных заболеваний овощных культур в условиях защищенного грунта. Статистическую обработку данных проводили с применением программы Statistica 10, сравнивая противовирусную активность препарата при обработке разными концентрациями. Оценку различий проводили методом Фишера.
Скрининг на наличие/отсутствие вируса зеленой крапчатой мозаики (ВЗКМО) и вирус обычной мозаики (ВОМ) производили раз в две недели. В качестве исследуемого материала использовали верхушки растений и смывы с поверхностей помещений. После выявления РНК вирусов в исследуемом материале до проявления признаков вирусной инфекции исследования производили еженедельно.
От момента выявления РНК в исследуемом материале, до появления признаков инфекции был инкубационный период вируса, который в среднем составлял 3 недели. Появление первых признаков вирусной инфекции на верхушках растений, в виде скручиваний, звездчатости, мозаичности, укороченных междоузлий, условно считали первым после появления признаков вирусной инфекции. Далее последующими контрольными точками считали еженедельные визуальные скрининговые обследования на наличие вирусной инфекции.
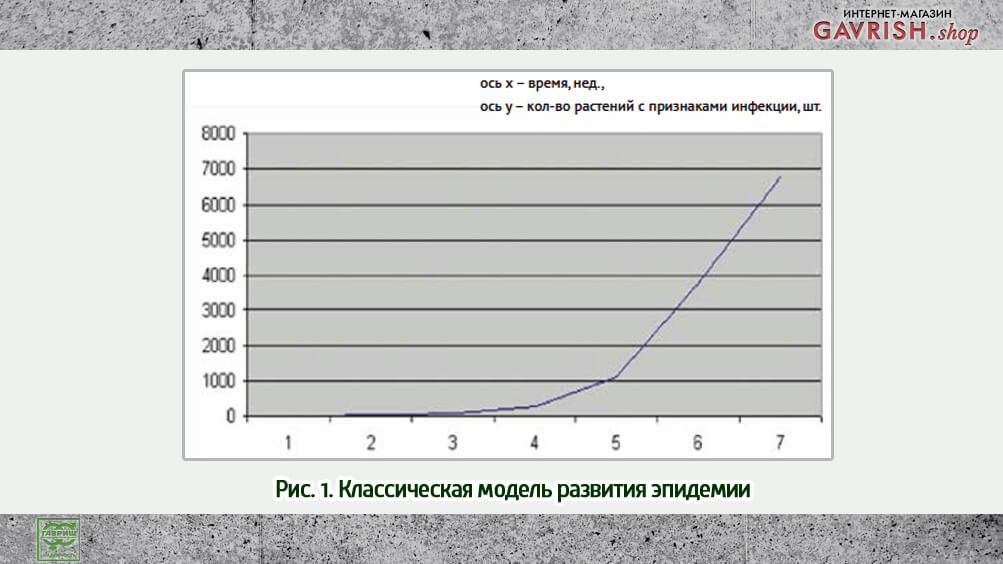
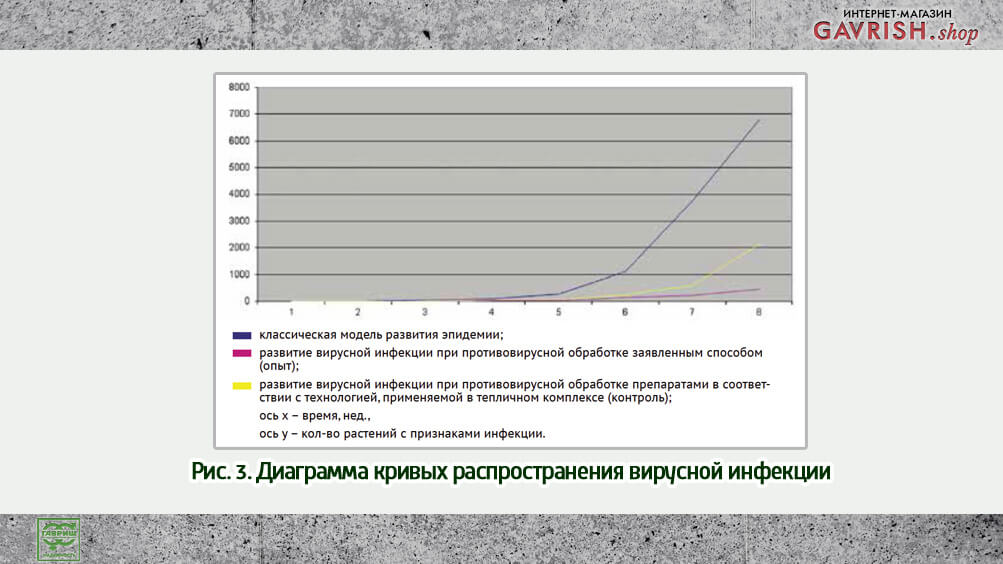
Известно, что при устойчивости организма к вирусным инфекциям, эпидемия развивается вначале по прямой, а затем экспоненциально (рис. 1). Применение комбинированной системы распространения вирусной инфекции, основанной на визуальной оценке и контроле вирусной нагрузки как в помещении, так и в растениях, позволило оптимизировать способ противовирусной обработки.
Такой подход позволяет рассчитать концентрацию противовирусного препарата с учетом накопления вирусной инфекции как в помещении тепличного комплекса, так и непосредственно в растениях. А также спрогнозировать необходимое количество препарата с учетом цикла репликации вируса в соответствии с математической моделью распространения эпидемического процесса.
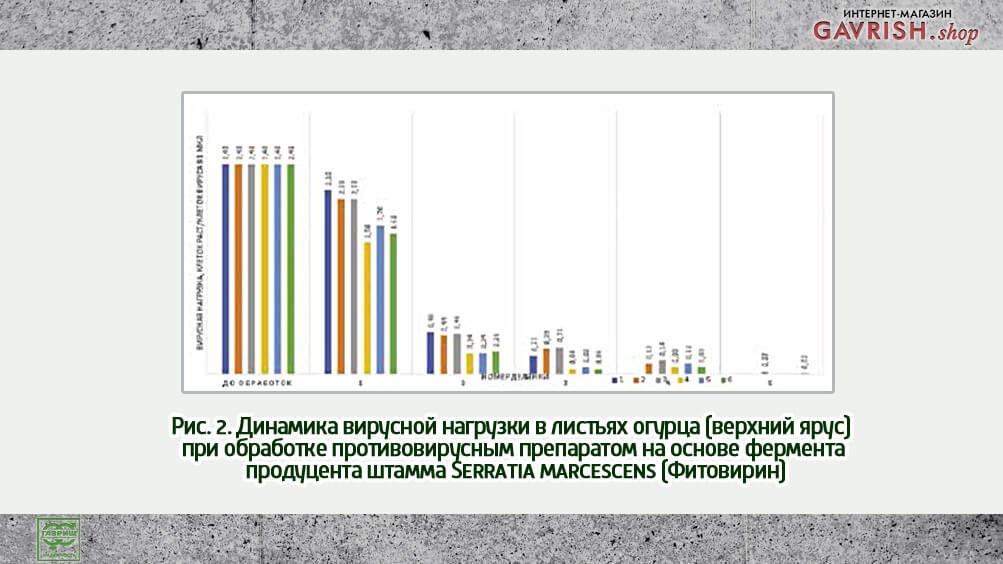
Вирусную нагрузку оценивали молекулярно-генетическими методами с применением количественной тест-системы с флуоресцентными метками. На начало эксперимента было обнаружено 5 растений с признаками инфекции, при этом вирусная нагрузка в растениях составила 2,4. На поверхностях вирусная нагрузка составила 1,4.
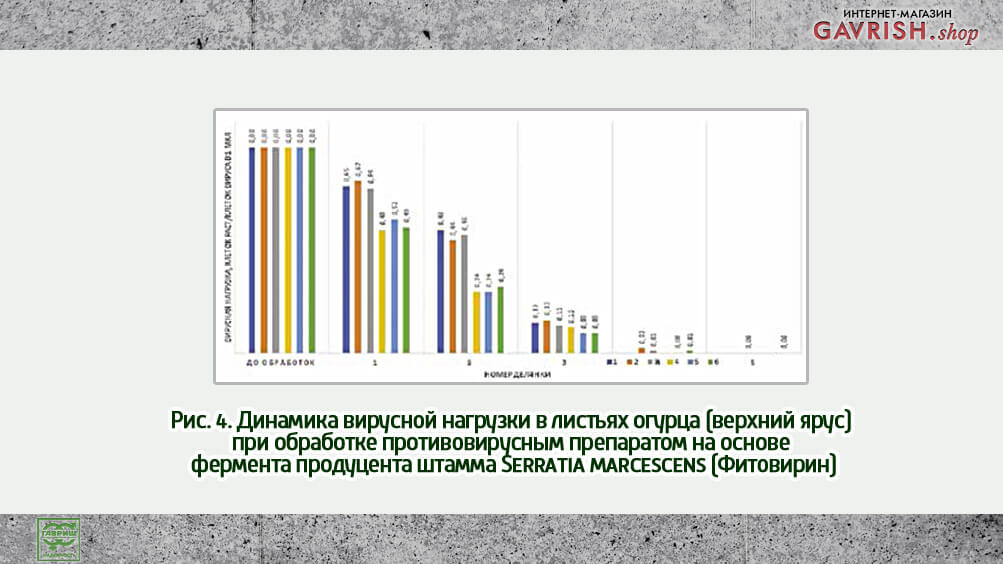
Обработку производили методом опрыскивания. Применяли препарат концентрацией от 8 до 12 млн ед.акт. на 600 л воды, активировали эндонуклеазу MgSO4. Обработку проводили еженедельно с кратностью от 3 до 5 раз из расчета по 2 млн ед.акт. Оценивая динамику вирусной нагрузки в листьях огурца, следует обратить внимание на значительное (р<0,001)^3 снижение показателей у растений 4, 5, 6 делянок после первой обработки концентрацией 1500 ед/активности на 1 растение с сохранением эффективности 4 обработок. При 5 обработке вирусная нагрузка снижалась незначительно.
Вирусная нагрузка на делянках, обработанных разной концентрацией препарата, отличалась не достоверно, что говорит о возможности снижения концентрации рабочего раствора до 1000 ед.акт. на растение, для 4 обработки.
Вирусная нагрузка после 4-кратного применения фермента на опытных участках не превышала 0,16. При начале применения противовирусной обработки Фитовирином сразу после обнаружения первых признаков развития вирусной инфекции можно купировать эпидемический процесс и прогнозировать дальнейшее его развитие по линейной модели.
Оптимальная концентрация Фитовирина для противовирусной обработки составила 1500 ед.акт. на 1 растение, при 4-кратном применении, со снижением концентрации 4 обработки до 1000 ед.акт. на 1 растение.
Оптимизация условий применения препарата для защиты от ВОМ и ВЗКМО в тепличных хозяйствах
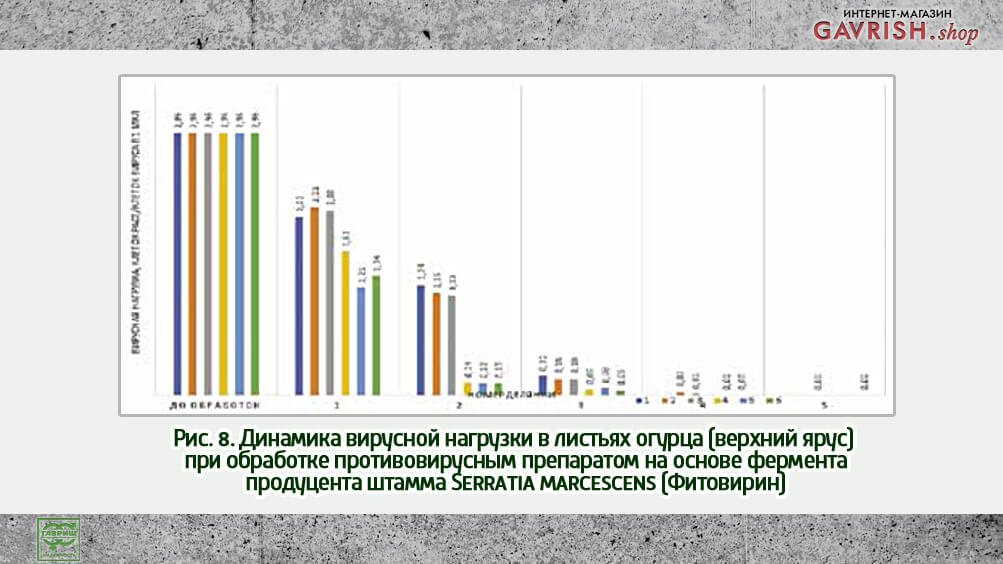
Исследования проводили в производственных условиях в тепличном комплексе без применения интерплантинга. До обработки проводили отбор проб для определения вирусной нагрузки, которая составила 0,8; вирусная нагрузка на поверхностях 0,25. После 5 обработок количество вирусных копий в смывах с поверхностей и настила было следовым, как и в образцах растений. Снижение накопления вирусной инфекции и визуальное проявление вирусной инфекции находятся в разных временных диапазонах.
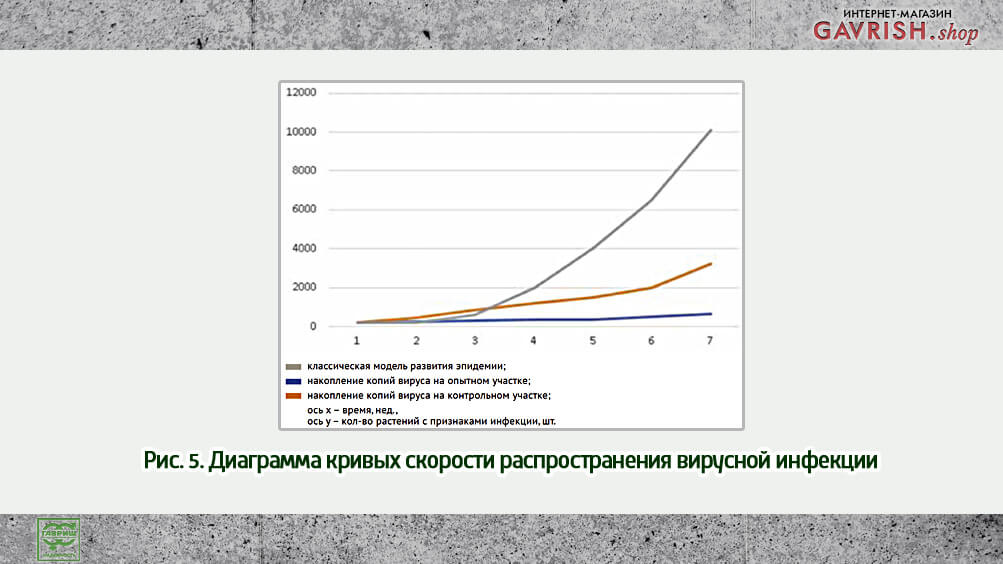
Так, при противовирусной обработке, вирусная нагрузка снижается уже после первого применения, однако визуально распространение инфекции возрастает, так как выявляют новые растения с признаками инфицирования (рис. 4, 5). На графике отмечается экспоненциальное распространение инфекции, с тенденцией к переходу в линейное, после применения препарата. Что говорит о сдерживании эпидемического распространения, но при этом достаточно быстрых темпах развития очагов инфекции в контроле (рис. 5).
При обработке опытных делянок противовирусным препаратом в разных концентрациях динамика вирусной нагрузки значительно варьировалась. Так, после второй обработки было отмечено наиболее значительное (р<0,001) снижение вирусной нагрузки (рис. 4). В то время как, после третьей обработки снижение вирусной нагрузки между вариантами отличалось не достоверно, что позволяет снизить концентрацию препарата уже к 3 применению.
Своевременное применение препарата до появления признаков инфекции, с учетом достижения максимально допустимой ƛ вирусной нагрузки, позволит не только купировать распространение инфекции, но и сохранить урожай с наименьшими затратами на защиту от инфекций.
Оптимизация условий применения препарата Фитовирин в тепличных хозяйствах при органической системе выращивания, без применения интерплантинга
Эксперимент проводили в условиях тепличных хозяйств. Фермент концентрацией 50 тысяч единиц активности разводили в 3 л воды, температура которой от 37 до 50 °С; измеряли рН, оптимальным считали рН=8, допустимым 7-9. После чего к нему добавляли активатор фермента 12,5 г, размешивали концентрированный раствор до полного растворения MgSO4.
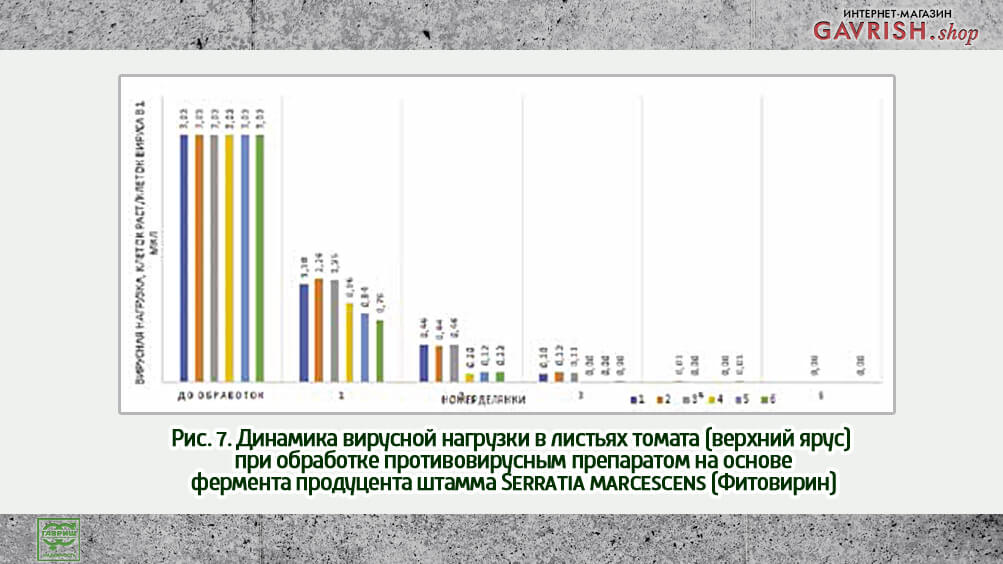
До обработки проводили отбор проб для определения вирусной нагрузки, которая составила 3,02 на томатах и 2,96 на огурцах; вирусная нагрузка на поверхностях 1,6 в теплице с томатами и 1,2 в теплице с огурцами. После 5 обработок количество вирусных копий в смывах с поверхностей, настила и в образцах растений было следовым. Распространение вируса оценивали по визуальным признакам, основным признаком развития инфекции считали «игольчатость» листьев томатов. Всего на участке было 250 томатов (рис. 6).
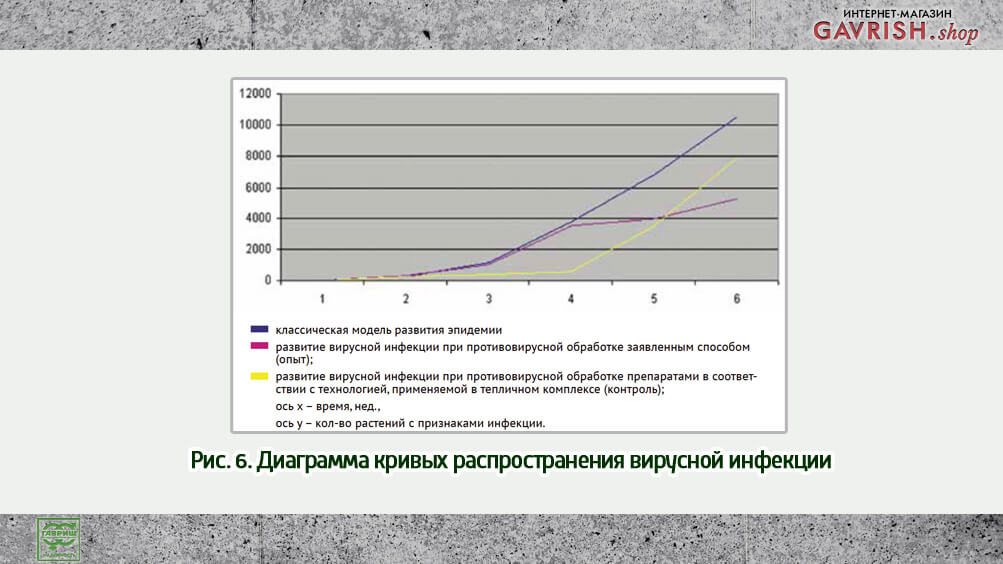
При обработке опытных делянок противовирусным препаратом в разных концентрациях следует отметить, что уже после первого применения вирусная нагрузка в вариантах снизилась минимально у растений на второй делянке до 2,12 максимально.
Существенное снижение уже после первой обработки, возможно, обусловлено физиологическими особенностями томата. При обработке огурцов с начальной вирусной нагрузкой 2,96 отмечалась положительная устойчивая динамика снижения вирусной нагрузки. Оптимальная концентрация фермента 1500 ед.акт. на 1 растение, при 3-кратном применении с интервалом 7 дней.
Проведение лабораторных исследований по изучению противовирусной активности универсального противовирусного препарата in vitro и in vivo начинали с этапа цветения. Искусственно инфицировали по группам со снижением концентрации вируса на 1 порядок в каждой из групп (рис. 9). Растения контрольной группы не инфицировали. Каждую группу растений располагали в изолированном пространстве. Контаминация между группами была исключена.
На начало исследования в растениях опытных и на контроле были обнаружены единичные копии вируса. Предположительно, данный вирус попал в рассаду с семенами.
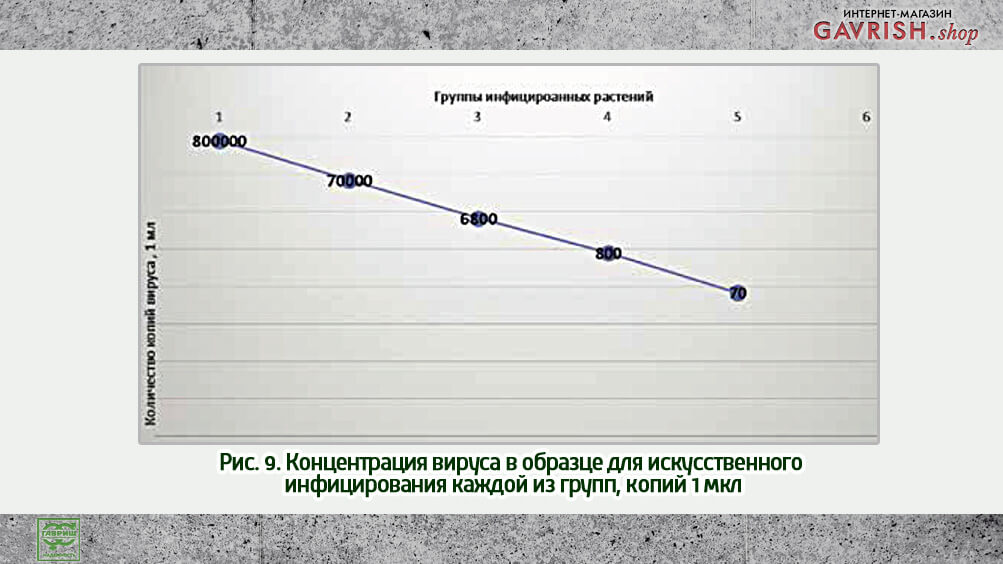
Следует обратить внимание, что при искусственном инфицировании растений ВЗКМО в указанных концентрациях, при резко возросшей концентрации в каждой из групп до 2,6х10^16 тенденция развития вирусной инфекции в каждой из групп оставалась неизменной, что предположительно говорит об отсутствии как таковой ƛ инфицирования, и влиянии периода воздействия инфекции на развитие вирусной инфекции.
В лабораторных условиях при отсутствии сдерживающих факторов, нарастание вирусной инфекции в растениях в течение 5 недель перешло в экспоненциальную стадию с накоплением вирусной нагрузки более 9 (клеток вируса/клеток растения в 1 мкл).
При отсутствии профилактических мероприятий в производственном цикле, вирусная нагрузка в растениях развивалась бы по прямой с резким переходом в экспоненциальную стадию.
Итоговая оценка эффективности Фитовирина
Таким образом, разработанный способ противовирусной обработки овощных культур в производственных условиях, с применением фермента в концентрации 1500 ед.акт. на 1 растение (трехкратно) и 1000 ед.акт. на 1 растение при 4 обработке, позволяет купировать распространение инфекционного процесса, снизить вирусную нагрузку на обрабатываемом участке. Применение препарата в профилактических целях, до появления визуальных признаков инфекции, позволяет добиться полной ремиссии инфекционного процесса. При применении препарата по разработанному способу листовые пластины верхнего яруса отрастают визуально полностью здоровыми. Листовые пластины среднего яруса не содержат вируса (ПЦР), однако при этом не полностью восстанавливают здоровый вид, при визуальной оценке на некоторых листьях был отмечен хлороз.

Заявленная методика расчета концентрации и кратности применения препарата позволяет контролировать распространение вирусной инфекции. Расчет ограничен 4 неделями, далее применение средств защиты с целью борьбы с вирусными инфекциями малоэффективны и экономически не целесообразны, ввиду развития экспоненциальной стадии эпидемии, которую сложно купировать и остановить распространение инфекции.
Внесение дополнительных веществ, препаратов допустимо через один полив (то есть следующий полив за внесенным ферментов не предполагает дополнительных препаратов, после него можно вносить предусмотренные технологией выращивания препараты); время действия препарата ограничивается следующим поливом растения, предусмотренным технологией выращивания); кратность обработки препаратом – еженедельно.
Н.В. Блажко, С.Х. Вышегуров, Ю.И. Хрипко, В.А. Рябинина, С.Е. Пашковский — Новосибирский государственный аграрный университет
Библиографический список:
1. Бароян О.В., Рвачев Л.А. Математика и эпидемиология. – М., «Знание»,1977.
2. Блажко Н.В. Применение экологически чистого противовирусного препарата «Фитовирин» для обработки овощных культур, выращиваемых в условиях закрытого грунта // Н.В. Блажко, С.Х. Вышегуров, Ю.И. Хрипко, В.А. Рябинина, А.В. Седунов, Н.Ю. Мошкина / Research in: Agricultural & Veterinary Sciences Vol.2, No.1, – 2018, pp.24-31
3. Блоцкая Ж.В., Вабищевич В.В. Ингибирование вируса зеленой крапчатой мозаики огурца путем обработки семян фиторосторегуляторами // Домаш В.И., Азизбекян С.Г., Завадская М.И., Хрипач В.А. Доклады Национальной академии наук Беларуси. 2010. – Т. 54. № 4.-С. 97100.
4. Боев. Б.В. Современные этапы математического моделирования процессов развития и распространения инфекционных заболеваний // Эпидемиологическая кибернетика: модели, информация, эксперименты. М., 1991.-С. 111-114.
5. Вабищевич В. В., Блоцкая Ж. В. // Земляробства i ахова раслiн. 2009. № 5.-С. 66–68.
6. Руднева Т.С., Будзанивская И.Г., Шевченко Т.П., Полищук В.П. // Материалы междунар. науч. конф. «Защита растений: стратегия и тактика защиты растений», 28 фев. – 2 марта 2006 г., Минск. – Минск, 2006.-Ч. 1.-С. 303-305.
7. Смирнова Н., Царькова Л., Шуваев В. // Овощеводство и тепличное хозяйство.-2009.-№ 6.-С. 5-10.
8. Фоминых Т. С. // Агро ХХI. 1999.-№ 1.-С. 20.
9. Хлебородов А. // Овощеводство и тепличное хозяйство. 2008. № 2. С. 34–36.
10. Шпаар Д. Защита растений в устойчивых системах землепользования. Торжок, 2003.-Кн. 1.-С. 111-112.
11. Ainsworth G.C. Mosaic disease of cucumber // Ann. Appl. Biol. 1935. V. 22. P. 55–67.
12. Ali A., Natsuaki T., Okuda S. Identification and molecular characterization of virus infecting cucurbits in Pakistan // J. Phytopathol. 2004. V. 152. P. 677–682.
13. Benedik M. J., Strych U. Serratia marcescens and its extracellular nuclease // FEMS Microbiology Letters 165, 2013, р. 1-13.
14. Carrington J.C. , Kasschau K.D., Mahajan S.K., Schaad M.C. Cell-to-cell and long-distance transport of viruses in plants // Plant Cell. 1996. V. 8 (10). P. 1669– 1681.
15. Hilf M.E., Dawson W.O. The tobamovirus capsid protein functions as a host-specific determinant of long-distance movement // Virology. 1993. V. 193. P. 106–114.
16. Holt C.A., Hodgson R.A., Coker F.A. et al. Characterization of the masked strain of tobacco mosaic virus: identification of the region responsible for symptom attenuation by analysis of an infectious cDNA clone // Mol. Plant Microbe Interact. 1990. V. 3(6). P. 417-423.
17. Ichiki T.U., Nagaoka E.N., Hagiwara K. et al. Integration of mutations responsible for the attenuated phenotype of Pepper mild mottle virus strains results in a symptomless cross-protecting strain // Arch. Virol. 2005. V. 150(10). P. 2009-2020.
18. Kim S., Lee J., Yim K. et al. Nucleotide sequences of two Korean isolates of Cucumber green mottle mosaic virus // Mol. Cells. 2003. V. 16 (3). P. 407-412.