Динамика вирусной нагрузки на растения
В условиях интенсивного производства, с применением системы контроля микроклимата, применение технологии интерплантинга приводит к регулярному стрессированию растений и созданию благоприятной среды для роста и развития вирусных инфекций. Особенно актуально это для овощеводства, использующего защищенный грунт.
Вирусные заболевания огурца
По данным Минсельхоза России, около 70% всех сборов тепличных овощей приходится на огурцы. Вирусные болезни, несмотря на большое количество устойчивых гибридов, регистрируются повсеместно. Наиболее часто встречаемым в защищенном грунте патогеном является вирус зеленой крапчатой мозаики огурца (CGMMV).
Это РНК-содержащий вирус, к которому чувствительны растения семейства тыквенных. Симптомами заболевания являются: пятнистость, звездчатость, деформация листьев, укороченные междоузлия, задержка роста. Плоды обычно не изменены, однако могут наблюдаться изменение окраски, формы, вкусовых качеств. Потери урожая от заражения CGMMV могут достигать 40%.

Диагностика вирусного поражения растений
Комплекс диагностических мероприятий, применяемых в тепличных комбинатах, включает в себя визуальную диагностику растений на выявление признаков инфекции и лабораторную диагностику. Использование современных методов диагностики, в частности ПЦР-анализа, позволяет обнаруживать наличие вирусов в растении даже при скрытом течении инфекции (латентной форме).
Так как возможность провести необходимые диагностические исследования существует не на всех комбинатах, то о наличии вирусных заболеваний, как правило, говорят только когда их признаки становятся заметны невооруженным глазом.
Такой подход позволяет предпринимать меры, лишь сдерживающие дальнейшее распространение вируса среди растений. На момент проявления признаков инфекций концентрации циркулирующего патогена превышают 10^9 в 1 млк пробы. При таких концентрациях дальнейшая борьба с вирусом не принесет существенного результата, а сохранить качественный урожай практически невозможно.
Целью нашего исследования стало изучение динамики накопления вируса в растениях и соотношения накопления вирусной нагрузки с визуальными признаками развития инфекции. А также распределение вирусной нагрузки по ярусам растений.
Материалы и методы исследований вируса зеленой крапчатой мозаики огурца
Исследования проводили на базе лаборатории энзимного анализа и ДНК-технологий Новосибирского ГАУ, на огурцах сорта Мева F1 (Rijk Zwaan).
Инфицирование растений осуществляли в фазе четырех настоящих листьев. Предметом исследования был выбран вирус зеленой крапчатой мозаики огурца.
Суть эксперимента заключалась в искусственном инфицировании пяти групп растений огурца CGMMV в разных концентрациях. Раствор для заражения готовили методом последовательных разведений, начиная с 10^6 до 10^2 копий вируса в 100 мкл. Растения инфицировали методом опрыскивания со 100% покрытием листовых пластин. Растения контрольной группы не инфицировали. Для предотвращения переноса инфекции между группами их располагали в изолированных помещениях.
Для оценки степени поражения мозаикой применяли пятибалльную систему: 0 или 1 – растения внешне здоровы; 2 – слабая мозаичность листьев верхушки, звездчатость; 3 – отчетливая мозаичность верхушечных листьев, звездчатость, признаки инфекции на листьях среднего и нижнего ярусов отсутствуют, задержка роста незначительная; 4 – яркие признаки мозаичности и звездчатости на листьях и венчиках цветков, хлоротичность листьев растения, задержка роста, опадение завязей.
Для подтверждения инфицирования и дальнейшего определения вирусной нагрузки (копий вируса / 100 мкл) использовали метод количественной ПЦР. Для этого с интервалом 1 раз в неделю отбирали листья с верхнего, среднего и нижнего ярусов растений. Из тканей листа выделяли геномную РНК вируса с последующим этапом обратной транскрипции и постановкой полимеразной цепной реакции с применением авторской тест-системы.
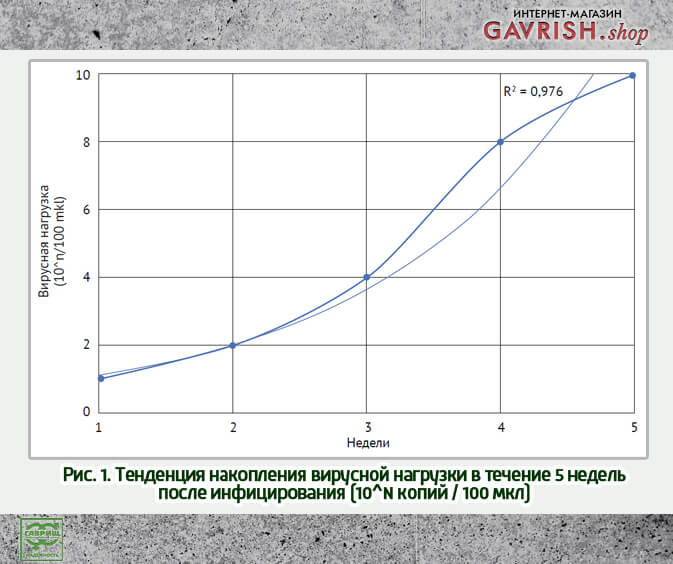
Вирус крапчатой мозаики развивается независимо от начальной вирусной нагрузки
На начало исследования все группы растений были проверены на наличие CGMMV методом количественной ПЦР. В растениях опытных и контрольной групп были обнаружены единичные копии вирионов. Начальная доза инфицирования не оказывала влияния на динамику развития инфекционного процесса, во всех опытных группах вирусная нагрузка составляла 10^15
При этом подтверждалась тенденция развития вирусной инфекции в каждой из групп в течение 5 недель, которая из линейной переходила в экспоненциальную стадию (рис. 1).
Накопление вирусной нагрузки в растениях не зависит от начальной концентрации вируса в растворе, которым было инфицировано растение, что подтверждается низким коэффициентом корреляции (r = 0,029). Кроме того, установлена связь между концентрацией вируса и периодом времени с момента инфицирования.
Подытоживая вышесказанное, следует отметить, что питание, микроклимат, стрессовые и генетические факторы оказывают влияние на развитие инфекционного процесса, однако вне зависимости от вышеперечисленного сохраняется закономерность экспоненциального накопления вирусной нагрузки.
До искусственного инфицирования растения были хорошо развиты, корневая система здоровая, без признаков нарушений.

На 2-й неделе эксперимента начали проявляться первые симптомы болезни. Они характеризовались заостренными краями листьев верхушки, при отрастании листовая поверхность становилась морщинистой, края загибались внутрь.
На 4-й неделе к перечисленным выше симптомам добавились слабовыраженные неорганизованные светло-зеленые пятна на листовой пластине, которые к концу опыта сформировали четкую мозаичность (рис. 2).
В ходе опыта было установлено, что различные симптомы проявляются в зависимости от степени накопления вирусной нагрузки. Мозаичность в большей степени привязана к экспоненциальному отрезку кривой, а деформация листовой пластины – к линейному.
Определение накопления вирионов в различных ярусах растений огурца было изучено в момент экспоненциальной стадии развития инфекции.
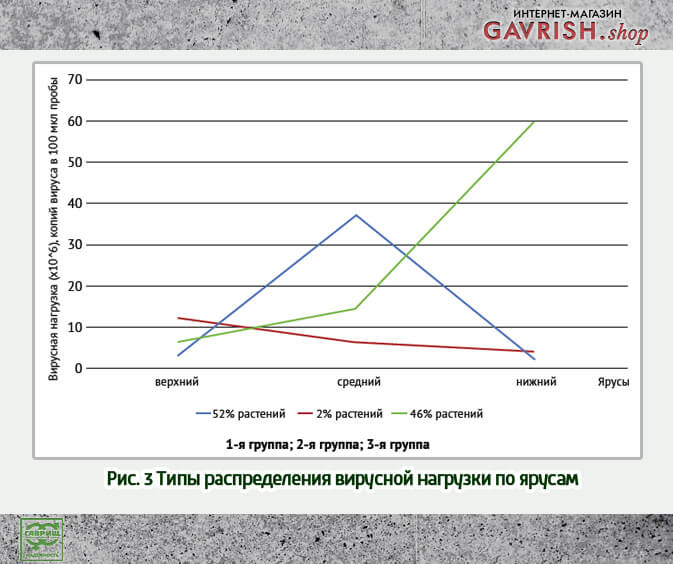
В этот период вирионы накапливались в основном в среднем и нижнем ярусах (рис. 3). Генеральная совокупность разделилась на три группы по распределению вирусной нагрузки в ярусах, наиболее многочисленными были две группы – 52 и 46 % соответственно, 2 % составляла 3-я группа, в которой самая высокая вирусная нагрузка приходилась на верхний ярус.
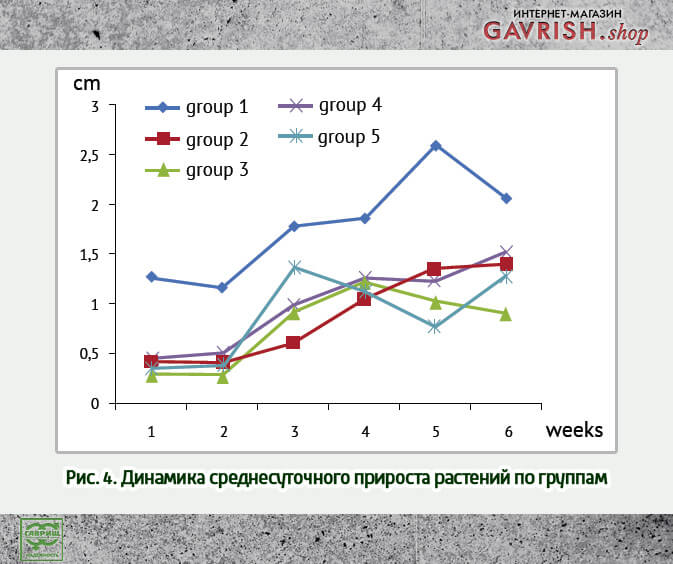
У некоторых растений наблюдалась существенная задержка роста. При этом закономерности среднесуточного прироста от концентрации вируса в растении и количества вируса при заражении не отмечалось. Это подтверждается неравномерностью графиков роста по группам (рис. 4) и принадлежностью всех выборок к единой совокупности.
Кроме изучения вирусной нагрузки CGMMV в растениях огурца, нами были проведено изучение вирусной нагрузки у растений при появлении первых признаков развития инфекционного процесса. То есть в тот самый момент времени, когда большинство специалистов защищенного грунта начинают предпринимать активные действия для сохранения урожая.
Данные по количественному содержанию вируса представлены в таблице.
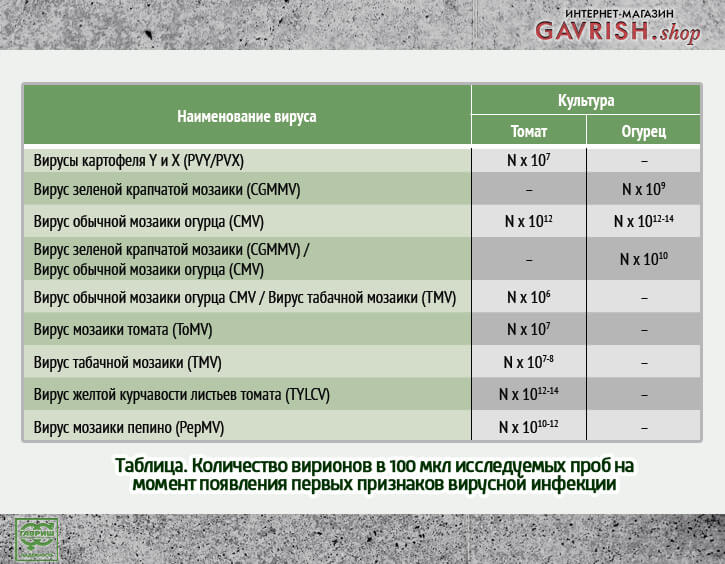
Следует обратить внимание, что вирусы CMV, TYLCV, PepMV развиваются бессимптомно до 10^10-14 копий, при такой высокой нагрузке борьба с вирусом в момент появления признаков инфекции уже малоэффективна. В данном случае применение противовирусных препаратов необходимо по схеме, позволяющей быстро снизить вирусную нагрузку, в противном случае урожай не удастся сберечь.
Как уменьшить распространение инфекции на огурцах — выводы
В ходе проведенных лабораторных исследований было установлено, что начальная концентрация вируса на момент инфицирования растений практически не коррелирует (r = 0,029) с динамикой вирусной нагрузки. Накопление вирусной нагрузки подчиняется экспоненциальному уравнению и зависит от продолжительности воздействия патогена на растение.
В условиях лабораторного опыта было установлено, что ярко выраженная мозаичность формируется на экспоненциальном отрезке накопления вирионов.
Также было установлено, что при ярко выраженных признаках CGMMV, определяемых визуально, наибольшее число вирусных частиц обнаруживается в среднем и нижнем ярусах (r = 0,99). При этом зависимости скорости роста растений от величины вирусной нагрузки не обнаружено.
Исходя из вышесказанного, в производственном цикле, при отсутствии профилактических мероприятий, вирусная нагрузка в растениях будет развиваться по прямой с резким переходом в экспоненциальную стадию.
Применение комбинированной системы диагностики вирусной инфекции, основанной на визуальной оценке и контроле вирусной нагрузки в растениях, позволит оптимизировать схемы противовирусных обработок, а информация о преобладании вирусных частиц в конкретном ярусе растения позволит модифицировать технологические операции для уменьшения распространения инфекции.
Плотников Кирилл Олегович, студент
Рябинина Валерия Алексеевна, заведующая лабораторией
Пашковский Кирилл Сергеевич, аспирант
Вышегуров Султан Хаджибикарович, доктор сельскохозяйственных наук, профессор, заведующий кафедрой
Блажко Наталья Владимировна, кандидат биологических наук, заведующая лабораторией
ФГБОУ ВО Новосибирский ГАУ
---
[1] I.M. Huseynova, S.Y. Suleymanov, J.A. Aliyev, Structural-functional state of thylakoid membranes of wheat genotypes under water stress, Biochim. Biophys. Acta., Vol.1767., No 6., рр. 869–875, 2007.
[2] Н.В. Блажко, С.Х. Вышегуров, Ю.И. Хрипко, В.А. Рябинина, С.Е. Пашковский, «Противовирусная активность ферментного препарата на основе продуцентов Serratia marcescens (Фитовирин) при естественном и искусственном инфицировании овощных культур Tobamovirus», Гавриш, No 1, с. 42– 49, 2019.
[3] Л.Д. Гришечкина, «Проблемы защиты овощных культур от болезней в теплицах», Защита и карантин растений, No 2, с. 11–16, 2011.
[4] Е.М. Мунтян, П.Б. Ильев, М.Г. Батко, И.К. Ильева, А.В. Бандалак, И.Г. Язловецкий, «Мониторинг численности трипсов на сладком перце и томатах в теплице», Защита и карантин растений, No 1, с. 38–40, 2015.
[5] А.К. Ахатов, «Огурцы и томаты в теплицах», Приложение к журналу «Защита и карантин растений», No 2, с. 70–125, 2011.
[6] A.L.N. Rao, A. Varma, Transmission Studies with Cucumber Green Mottle Mosaic Virus, Journal of Phytopathology, Vol. 109, No 4, с. 325–331, 1984.
[7] J.T. Fletcher, A.J. George, D.E. Green, Cucumber Green Mottle Mosaic Virus, its Effect on Yield and its Control in the Lea Valley, England, Plant Pathology, Vol. 18, No 1, рр. 16–22, 1969.
[8] A.D. Aveglis, C. Vovlas, Occurrence of cucumber green mottle mosaic virus in the island of Crete (Greece), Phytopathologia Mediterrancea, No 25, рр. 166–168, 1986.
[9] N.W. Schaad, R.D. Frederick , Real-time PCR and its application for rapid plant disease diagnostics, Canadian Journal of Plant Pathology, Vol. 24, No 3, рр. 250–258, 2002.
[10] R. Sanjuan, P. Domingo-Calap, Mechanisms of viral mutation, Сell Mol. Life Sci, Vol. 73, No 23, рр. 4433–4448, 2016.
[11] В.И. Кошникович, Учет и прогноз болезней растений: Учеб. пособие. СА: Новосиб. гос. аграр. ун-т., 2005.
[12] Г.Ф. Лакин, Биометрия. СА: Высшая школа, 1990.
[13] Л.А. Животовский, Популяционная биометрия. СА: Наука, 1991.
[14] Л.Г. Громыко, Теория статистики. 2-е изд., перераб. и доп. СА: ИНФРА-М, 2010.
[15] E. Waigmann, S. Ueki, K. Trutnyeva and V. Citovsky, The Ins and Outs of Nondestructive Cell-to-Cell and Systemic Movement of Plant Viruses, Critical Reviews in Plant Sciences, Vol. 23, No. 3, pp. 195–250, 2004.







